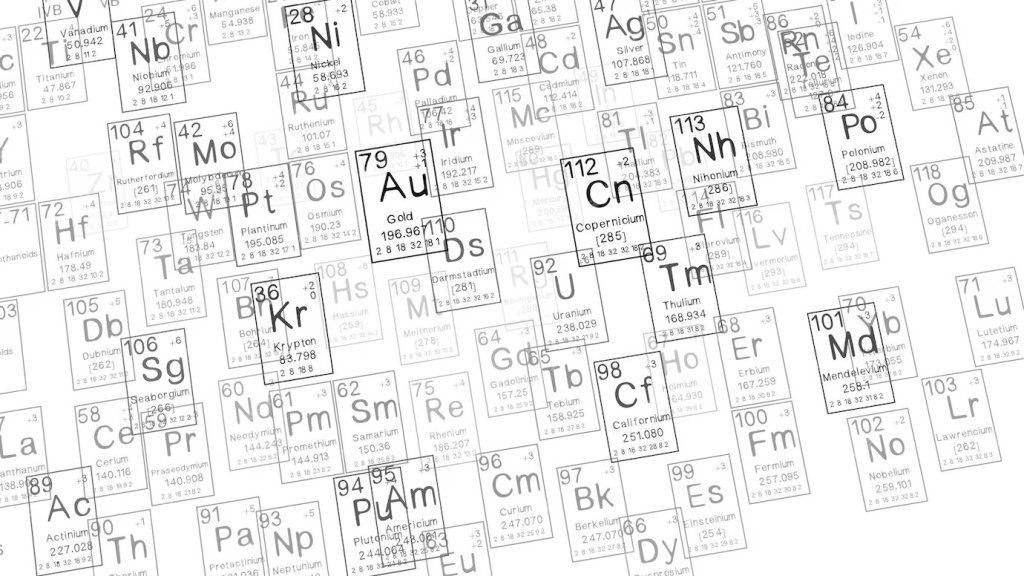
Научный мир различает более сотни химических элементов, которые группируются в металлы и неметаллы на основании их уникальных физических и химических свойств. Эти свойства напрямую зависят от атомного строения каждого элемента. Такая систематизация значительно облегчает понимание того, как элементы ведут себя в естественной среде и каковы их потенциальные применения в разнообразных областях человеческой деятельности.
Чем отличаются металлы и неметаллы?
Еще в XVIII веке выдающийся ученый Михаил Ломоносов обратил внимание на ключевые особенности металлов, описав их как «твердые, ковкие и блестящие вещества». Действительно, металлы обладают уникальными свойствами: они легко поддаются обработке, проводят тепло и электричество, а также отличаются пластичностью. Однако различия между металлами и неметаллами гораздо шире и охватывают не только физические, но и химические аспекты.
Металлы редко встречаются в природе в чистом виде. Чаще всего они входят в состав руд или образуют соединения, такие как оксиды, сульфиды и карбонаты. Чтобы получить чистый металл, его извлекают из руды и подвергают очистке. Для улучшения свойств металлов используются легирующие добавки или специальные методы обработки. Эти процессы изучает металлургия – наука, которая занимается получением и обработкой металлов.
Металлургия классифицирует металлы на две основные группы: черные (на основе железа) и цветные (около 70 элементов). Особую категорию составляют благородные металлы, такие как золото, серебро и платина, которые ценятся за свою устойчивость к коррозии и редкость. Интересно, что металлы можно обнаружить не только в земной коре, но и в морской воде, а также в организмах живых существ.
В человеческом организме доля металлов составляет приблизительно 3% от общей массы. К примеру, кальций является основой для структуры костей, натрий поддерживает гидро-солевой обмен, магний способствует работе мышц и центральной нервной системы, медь важна для функций печени, а железо необходимо для формирования гемоглобина в крови.
С другой стороны, неметаллы проявляют себя в разнообразных физических состояниях в природе. Некоторые из них существуют в газообразной форме, в то время как другие (фосфор, кремний, бор) обычно встречаются в твердом виде. Особое исключение составляет бром, который при нормальных условиях является жидким.
Кроме того, неметаллы известны своей способностью формировать аллотропные модификации, которые представляют собой разные структурные формы одного и того же элемента. Например, кислород может присутствовать в виде молекулярного кислорода O2 или озона O3. Углерод может принимать формы алмаза, графита, графена, фуллеренов и углеродных нанотрубок. Существует предположение о наличии других аллотропных форм углерода, включая чаоит и металлический углерод.
Большинство неметаллов в природе входят в состав химических соединений, таких как вода, минералы, скальные породы, силикаты, фосфаты и бораты, хотя встречаются и в свободном виде, как, например, азот, кислород и сера. Разнообразие их присутствия в атмосфере и земной коре значительно варьируется: элементы как кислород, кремний и водород обильны, тогда как мышьяк, селен и йод встречаются гораздо реже.
Такова роль металлов и неметаллов в природе и в жизни людей, что их свойства и взаимодействия остаются в центре внимания научных исследований и имеют широкое практическое применение.
Строение металлов и неметаллов
Главные отличия между металлами и неметаллами заключаются в их атомной структуре и свойствах, которые определяются их расположением в периодической системе элементов. Если представить соединение элементов условными линиями, можно увидеть их кристаллическую решетку – сложную структуру, узлы которой формируются атомами, молекулами или ионами (частицами с зарядом).
Для неметаллических элементов характерна атомная кристаллическая решетка, где частицы удерживаются ковалентными связями. Такие вещества, как фосфор, кремний или графит, обладают высокой твердостью и нелетучестью.
Молекулярные кристаллические решетки неметаллов отличаются менее прочными связями. Именно поэтому такие элементы чаще встречаются в газообразном или жидком состоянии, а в твердом виде они обычно имеют низкую температуру плавления.
Атомы металлов имеют уникальную способность терять внешние электроны, превращаясь в катионы – положительно заряженные частицы. Эти катионы взаимодействуют с электронами, образуя нейтральные частицы. Кристаллическая решетка металлов включает катионы, атомы и свободные электроны, что объясняет их высокую электропроводность и пластичность.
Как определить группу элемента?
Внешние признаки и физические свойства не всегда позволяют точно классифицировать элемент как металл или неметалл. Основное различие кроется в строении атомов. У металлов на внешнем уровне обычно находится от одного до трех электронов, которые легко отдаются из-за большого радиуса атома. Это делает металлы сильными восстановителями.
Принадлежность элемента к металлам или неметаллам можно определить по его положению в таблице Менделеева. Если провести воображаемую линию от бора (№ 5) до астата (№ 85), то справа от нее окажутся неметаллы, которых насчитывается всего 22. Металлы расположены слева от этой линии, преимущественно в I, II и III группах.
Атом состоит из трех основных частиц: протонов, нейтронов и электронов. Протоны и нейтроны формируют ядро, а электроны вращаются вокруг него. Протоны имеют положительный заряд (+1), электроны – отрицательный (-1), а нейтроны нейтральны. Ядро атома всегда заряжено положительно, а электроны удерживаются вокруг него благодаря электростатическому притяжению. Количество протонов в ядре определяет атомный номер элемента.
Связь атомного номера и химических свойств элементов
С увеличением атомного номера ядро сильнее притягивает электроны, что затрудняет их отрыв. Это явление сопровождается ослаблением металлических черт и усилением неметаллических характеристик по мере роста числа протонов в ядре.
Количество энергетических уровней напрямую связано с периодом элемента в таблице Менделеева. Чем выше период, тем дальше от ядра расположены внешние электроны, что облегчает их отдачу. Это приводит к усилению металлических и ослаблению неметаллических признаков.
Несмотря на увеличение диаметра и заряда ядра с ростом числа уровней, ключевым фактором остается расстояние до внешних электронов. У неметаллов внешние уровни содержат больше электронов, что объясняет их способность активно окислять другие вещества. Наиболее выраженные окислительные свойства демонстрируют элементы VI и VII групп второго и третьего периодов.
Полностью заполненный энергетический уровень включает 8 электронов. Наибольшей окислительной активностью отличаются галогены с валентностью, равной единице. Лидером среди них является фтор, у которого отсутствуют незаполненные орбитали.
05.03.2025Прикрепите фото, эскиз или чертеж и получите бесплатный расчет в течении 20-30 минут.
Получите расчет в течении
20-30 минут
Сделайте эскиз или набросок на бумаге и укажите необходимые размеры, а мы переведем все в чертеж и произведем расчет.